第一部分 常见的酸
1. 定义:
在水溶液中解离时产生的阳离子全部是氢离子(或H+)的化合物
2. 常见酸的特性及用途
(1)盐酸
① 浓盐酸具有挥发性,敞口放置时瓶口形成白雾,有刺激性气味;纯净的浓盐酸是无色的液体
② 用途:用于金属除锈、电镀、化工生产等。人体胃液中含有盐酸,可帮助消化
(2)硫酸
① 不易挥发,无味;纯净的浓硫酸是无色、黏稠的油状液体
② 浓硫酸的特性:
吸水性:实验室中常用来作气体干燥剂
脱水性:可使蔗糖、纸张等脱水而炭化
腐蚀性:如果不慎将浓硫酸沾到皮肤上,应立即用大量水冲洗,然后涂上3%~5%的碳酸氢钠(或NaHCO3)溶液
③ 用途:用于金属除锈、生产车用电池、化肥、农药、精炼石油等
3.化学通性(酸5条)
酸具有通性的原因是:在水溶液中都能解离出H+(或氢离子)
(1)与酸碱指示剂反应:
能使紫色石蕊溶液变红,不能使无色酚酞溶液变色
(2)与活泼金属反应:
通式:酸+活泼金属→盐+H2↑(置换反应)
举例:

(3)与某些金属氧化物反应
通式:酸+金属氧化物→盐+H2O(复分解反应)
举例:

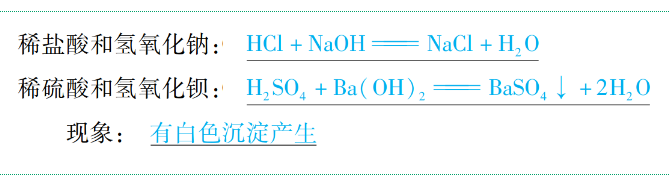
(4)与碱反应
通式:酸+碱→盐+H2O(复分解反应)
举例:
(5)与某些盐反应
通式:酸+盐→新酸+新盐(酸+碳酸盐→新盐+H2O+CO2↑)(复分解反应)
举例:
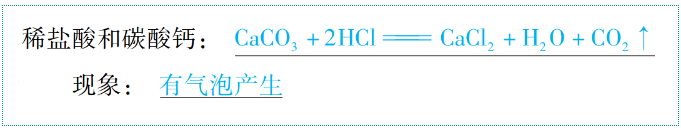
【注意】不同酸具有“个性”的原因是:含有的酸根离子(或阴离子)不同。
如:
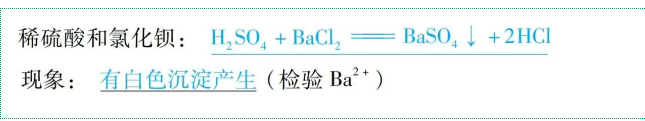
版权声明
声明:有的资源均来自网络转载,版权归原作者所有,如有侵犯到您的权益
请联系本站我们将配合处理!
