氧化还原反应在生产、生活中具有广泛的用途。
(1)下列生产、生活中的事例中没有发生氧化还原反应的是_____(选填编号)。
a. 海水提溴 b. 工业制氯碱 c. 海水晒盐 d. 海带提碘
(2)水是人体的重要组成部分,是人体中含量最多的一种物质。“四种基本反应类型与氧化还原反应的关”可用下图表示。
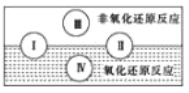
试写出有水参加且符合反应类型IV 的一个化学方程式:___________________。
(3)工业上利用NaIO3和NaHSO3反应来制取单质I2。
①配平下列化学方程式并标明电子转移的方向和数目:
_____NaIO3+_______NaHSO3→_______I2+_______Na2SO4+_______H2SO4+_______H2O
②该反应还原剂是_____,_____元素被还原,若生成1mol 氧化产物则转移电子数目为_____NA。
(4)已知:HSO3-、I2、I-、SO42-和一些未知物组成的一个氧化还原反应,其中SO42-是氧化产物,该反应中还原性HSO3-_____I-(填“>”或“<”),完成该反应_____________________________________。
【答案】 c 2F2+2H2O→4HF+O2或2Na+2H2O→2NaOH+H2↑或C+H2O CO+H2
CO+H2 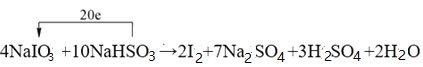 NaHSO3 I 2 > H2O + I2+ HSO3-→2I—+ SO42-+ 3H+
NaHSO3 I 2 > H2O + I2+ HSO3-→2I—+ SO42-+ 3H+
(1)凡是有元素化合价升降的反应都是氧化还原反应,所以选项ABD中都涉及氧化还原反应,选项C是物理变化,一定不是氧化还原反应,答案选C;(2)根据“四种基本反应类型与氧化还原反应的关系”图可知,Ⅳ是置换反应,因此符合条件的可以是2F2+2H2O→4HF+O2 或2Na+2H2O→2NaOH+H2↑或C+H2O CO+H2;(3)①化学反应中碘元素化合价从+5价降为0价,生成1mol碘单质共降低10价,硫元素的化合价从+4价升高到+6价,2molNaHSO3生成1molNa2SO4共升高了4价,根据电子守恒和原子守恒,则碘酸钠的前面系数是4,亚硫酸氢钠的系数是10,即4NaIO3+10NaHSO3=2I2+7Na2SO4+3H2SO4+2H2O,反应中生成2mol碘单质转移20mol电子数,故答案为:
CO+H2;(3)①化学反应中碘元素化合价从+5价降为0价,生成1mol碘单质共降低10价,硫元素的化合价从+4价升高到+6价,2molNaHSO3生成1molNa2SO4共升高了4价,根据电子守恒和原子守恒,则碘酸钠的前面系数是4,亚硫酸氢钠的系数是10,即4NaIO3+10NaHSO3=2I2+7Na2SO4+3H2SO4+2H2O,反应中生成2mol碘单质转移20mol电子数,故答案为: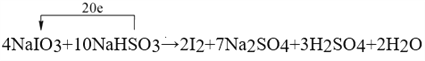 ;②硫元素的化合价升高,所以NaHSO3被氧化作为还原剂,氧化产物为硫酸钠和硫酸;I元素的化合价降低被还原,若生成1mol 氧化产物则转移电子数目为
;②硫元素的化合价升高,所以NaHSO3被氧化作为还原剂,氧化产物为硫酸钠和硫酸;I元素的化合价降低被还原,若生成1mol 氧化产物则转移电子数目为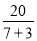 ×NA=2NA;(4)已知:HSO3-、I2、I-、SO42-和一些未知物组成的一个氧化还原反应,其中SO42-是氧化产物,则HSO3-是还原剂,硫元素化合价升高,则碘元素化合价降低,I2为氧化剂,I-为还原产物,化学反应中还原剂的还原性大于还原产物的还原性,故反应中还原性HSO3->I-,再结合氧化还原反应配平原则配平得该反应为:H2O + I2 + HSO3-=2I—+ SO42-+ 3H+。
×NA=2NA;(4)已知:HSO3-、I2、I-、SO42-和一些未知物组成的一个氧化还原反应,其中SO42-是氧化产物,则HSO3-是还原剂,硫元素化合价升高,则碘元素化合价降低,I2为氧化剂,I-为还原产物,化学反应中还原剂的还原性大于还原产物的还原性,故反应中还原性HSO3->I-,再结合氧化还原反应配平原则配平得该反应为:H2O + I2 + HSO3-=2I—+ SO42-+ 3H+。
版权声明
声明:有的资源均来自网络转载,版权归原作者所有,如有侵犯到您的权益
请联系本站我们将配合处理!
