元素周期表是学习物质结构与性质的重要工具。下表是元素周期表的一部分,表中所列字母a、b、c、d、e、f、g、m、n、o、r分别代表某一种元素。请回答下列问题。
元素周期表是学习物质结构与性质的重要工具。下表是元素周期表的一部分,表中所列字母a、b、c、d、e、f、g、m、n、o、r分别代表某一种元素。请回答下列问题。
a | |||||||||||||||||
c | b | n | |||||||||||||||
d | e | o | f | ||||||||||||||
m | r | g | |||||||||||||||
(1)g元素的原子序数为________;上述所给11种元素中非金属元素共有_______种。
(2)m元素在元素周期表中的位置_____;e、n二元素形成的稳定化合物的化学式为__________。
(3)o元素离子的电子式为________;化合物ba3的结构式为__________。
(4)用电子式表示化合物d2n的形成过程_________;
(5)d的最高价氧化物的水化物与e的最高价氧化物反应的离子方程式_______________。
(6)单质r与b的最高价氧化物的水化物的稀溶液反应的离子方程式________________。
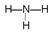
【答案】(1)33、7;(2)第四周期ⅡA族、Al2O3;(3)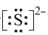 、
、 (4)
(4)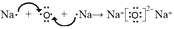 ;(5)2OH— + Al2O3= 2AlO2—+H2O;6)3Cu+8H++2NO3— = 3Cu2++2NO↑+4H2O。
;(5)2OH— + Al2O3= 2AlO2—+H2O;6)3Cu+8H++2NO3— = 3Cu2++2NO↑+4H2O。
(1)根据元素周期表,b为N,则g的原子序数为7+8+18=33,所给的非金属共有7种;(2)m在周期表的位置位于第四周期IIA族,e为Al,n为O,形成稳定的氧化物为Al2O3;(3)O为S,其离子带有2个单位的负电荷,离子为S2-,电子式为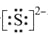 ,b为N,a为H,ba3为NH3,结构式为:
,b为N,a为H,ba3为NH3,结构式为: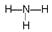 ;(4)d为Na,d2n为Na2O,属于离子化合物,电子式表示形成过程:
;(4)d为Na,d2n为Na2O,属于离子化合物,电子式表示形成过程: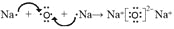 ;(5)Na的最高价氧化物对应水化物为NaOH,e的最高价氧化物为Al2O3,Al2O3为两性氧化物,其离子反应方程式为:Al2O3+2OH-=2AlO2-+H2O;(6)r为铜,铜和硝酸的反应离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O。
;(5)Na的最高价氧化物对应水化物为NaOH,e的最高价氧化物为Al2O3,Al2O3为两性氧化物,其离子反应方程式为:Al2O3+2OH-=2AlO2-+H2O;(6)r为铜,铜和硝酸的反应离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O。
版权声明
声明:有的资源均来自网络转载,版权归原作者所有,如有侵犯到您的权益
请联系本站我们将配合处理!
