在锌与盐酸反应的实验中,甲同学得到的结果如表所示:
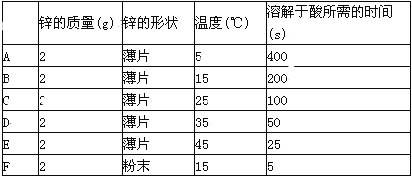
按要求回答下列问题:
(1)温度对该反应速率的影响规律为 _________________ .
(2)对比结果B与F,F速率明显快的原因是_________________.
(3)乙同学将表面积相同、纯度相同、体积也相同的同种锌片分别投入等体积、浓度不同的稀硫酸和稀盐酸中(两酸中的氢离子浓度相同),仔细观察后发现,投入到稀硫酸中的锌表面产生的气泡没有投入到稀盐酸的快,产生这一现象可能的原因是:____________.(只需回答一条即可)如何用实验来验证_________________.
【答案】(1)温度越高,反应速率越快;
(2)粉末状的锌粉与酸接触面积大,反应速率快;
(3)硫酸根离子可能是这一反应的负催化剂或氯离子则可能是正催化剂(只需回答一条即可);向锌和稀硫酸反应中加氯化锌若反应速率加快则证明氯离子是正催化剂,或向锌和稀盐酸反应中加硫酸锌溶液在反应中若反应速率慢则说明硫酸根离子是负催化剂(只需回答一条即可)。
【解析】(1)比较A、B、C、D、E数值,发现温度越高,化学反应速率越快;(2)对比B、F两组数值,影响反应速率的因素是接触面积,粉末状的反应速率快,粉末状的锌粉与酸接触面积大,反应速率快;(3)两者比较中,不同的是Cl-和SO42-,硫酸根离子可能是这一反应的负催化剂或氯离子则可能是正催化剂(只需回答一条即可);向锌和稀硫酸反应中加氯化锌若反应速率加快则证明氯离子是正催化剂,或向锌和稀盐酸反应中加硫酸锌溶液在反应中若反应速率慢则说明硫酸根离子是负催化剂(只需回答一条即可)。
版权声明
声明:有的资源均来自网络转载,版权归原作者所有,如有侵犯到您的权益
请联系本站我们将配合处理!
