有A、B、C、D、E五种元素,原子序数依次增大.A是短周期中族序数等于周期数的非金属元素;B元素的原子既不易失去也不易得到电子,其基态原子中每种能级电子数相同;C元素的价电子构型为nsnnpn+1;D
有A、B、C、D、E五种元素,原子序数依次增大.A是短周期中族序数等于周期数的非金属元素;B元素的原子既不易失去也不易得到电子,其基态原子中每种能级电子数相同;C元素的价电子构型为nsnnpn+1;D的最外层电子数与电子层数之比为3:1;E元素是我国最早使用的合金的主要成分元素.
(1)E元素在周期表中的位置______ ;E元素价电子排布式为______
(2)A分别与B、C、D能形成电子总数为10的化合物,它们的沸点由高到低的顺序是 ______ (写分子式).
(3)A与D形成的含有非极性键的分子的电子式为 ______ ,其中中心原子的杂化方式为______
(4)B、C、D三种元素的第一电离能由大到小的顺序是 ______ (用元素符号表示).
(5)含有A、C、D三种元素的化合物有多种,常温下,水溶液PH>7且能抑制水电离的弱电解质是 ______ ,水溶液PH<7且能促进水电离的强电解质是 ______ ,将这两种化合物按物质的量之比1:1混合于水中,所得水溶液PH=10,该溶液中离子浓度由大到小的顺序为______
(6)已知在25℃、101kPa下:ABC(aq)+A2D(1)=BC﹣(aq)+A3D+(aq)△H=+45.6kJ•mol﹣1
A3D+(aq)+DA﹣(aq)=2A2D(1)△H=﹣57.3kJ•mol﹣1
则在25℃、101kPa的稀溶液中,ABC与DA﹣反应的热化学方程式是(以离子方程式表示):______
【答案】(1)第4周期IB族;3d104s1
(2)H2O、NH3、CH4
(3)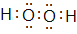 ;sp3
;sp3
(4)N>O>C
(5)NH3?H2O;NH4NO3;c(NH4+)>c(NO3﹣)>c(OH﹣)>c(H+)
(6)HCN(aq)+OH﹣(aq)═CN﹣(aq)+H2O(1)△H=﹣11.7kJ?mol﹣1
【解析】A、B、C、D、E五种元素的原子序数依次增大,A是短周期中族序数等于周期数的非金属元素,则A为H元素;B元素的原子既不易失去也不易得到电子,其基态原子中每种能级电子数相同,则B为碳元素;C 元素的价电子构型为nsnnpn+1 , 由于s能级最多容纳2个电子,且p能级容纳电子,故n=2,则C为N元素;D 的最外层电子数与电子层数之比为3:1,原子只能有2个电子层,最外层电子数为6,故D为O元素;E元素是我国最早使用的合金的主要成分元素,则E为Cu.
(1)E为Cu元素,价电子排布式为3d104s1 , 在元素周期表中的位置:第4周期IB族,
所以答案是:第4周期IB族;3d104s1;
(2)A分别与B、C、D能形成电子总数为10的化合物,分别为CH4、NH3、H2O,常温下水为液态,其它两种为气体,故水的沸点最高,而氨气分子之间存在氢键,沸点高于甲烷的,故它们的沸点由高到低的顺序是H2O、NH3、CH4 ,
所以答案是:H2O、NH3、CH4;
(3)A与D形成的含有非极性键的分子为H2O2 , 电子式为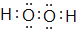 , 分子中O原子形成2个σ 键、含有2对孤对电子,杂化轨道数目为4,O原子的杂化方式为sp3 ,
, 分子中O原子形成2个σ 键、含有2对孤对电子,杂化轨道数目为4,O原子的杂化方式为sp3 ,
所以答案是: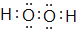 ;sp3;
;sp3;
(4)同周期随原子序数增大,第一电离能呈增大趋势,但N原子2P能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能:N>O>C,
所以答案是:N>O>C;
(5)含有H、N、O三种元素的化合物有多种,常温下,水溶液PH>7且能抑制水电离的弱电解质是NH3•H2O,水溶液PH<7且能促进水电离的强电解质是NH4NO3 , 将这两种化合物按物质的量之比1:1混合于水中,所得水溶液pH=10,溶液呈碱性,说明一水合氨的电离程度大于铵根离子的水解程度,该溶液中离子浓度由大到小的顺序为:c(NH4+)>c(NO3﹣)>c(OH﹣)>c(H+),
所以答案是:NH3•H2O;NH4NO3;c(NH4+)>c(NO3﹣)>c(OH﹣)>c(H+);
(6)已知在25℃、101kPa 下:HCN(aq)+H2O(1)═CN﹣(aq)+H3 O+(aq)△H=+45.6kJ•mol﹣1
H3 O+(aq)+OH﹣(aq)═2H2O(1)△H=﹣57.3kJ•mol﹣1
两热化学方程式相加可得:HCN(aq)+OH﹣(aq)═CN﹣(aq)+H2O(1)△H=﹣11.7kJ•mol﹣1
所以答案是:HCN(aq)+OH﹣(aq)═CN﹣(aq)+H2O(1)△H=﹣11.7kJ•mol﹣1 .
版权声明
声明:有的资源均来自网络转载,版权归原作者所有,如有侵犯到您的权益
请联系本站我们将配合处理!
